Terapeutické laserové prístroje sa používajú na celom svete už viac ako dvadsať rokov, ale len nedávno sa táto technológia širšie integrovala do bežnej lekárskej praxe. Technologické a výrobné inovácie umožnili, aby boli laserové prístroje cenovo dostupné a zároveň mali adekvátny výkon umožňujúci komplexnú terapiu v primeranom čase. S pribúdajúcimi štúdiami zisťujeme, že terapeutické lasery sú účinné v liečbe mnohých porúch.
Fotochemický efekt v cieľovej bunke nastáva po absorpcii laserového svetla chromoformi (časť bunky absorbujúca svetlo). Fotobiomodulácia, ako tento jav vedci výstižne pomenovali, je príkladom fotochemického procesu, v ktorom fotóny emitované z laserového zdroja pôsobia na cieľové bunky a spôsobujú stimulačné alebo inhibičné biochemické zmeny.
Existuje viac ako 3000 publikovaných štúdií o neablatívnej laserovej terapii. Mnohé z týchto štúdií boli vykonané na bunkách in vitro a ukázali presvedčivé výsledky týkajúce sa vplyvu laserového svetla na rôzne typy buniek. Dokázali zvýšenie angiogenézy, predĺženie neuritov, normalizáciu iónových kanálov, stabilizáciu bunkovej membrány a mnoho ďalších
bunkových zmien.
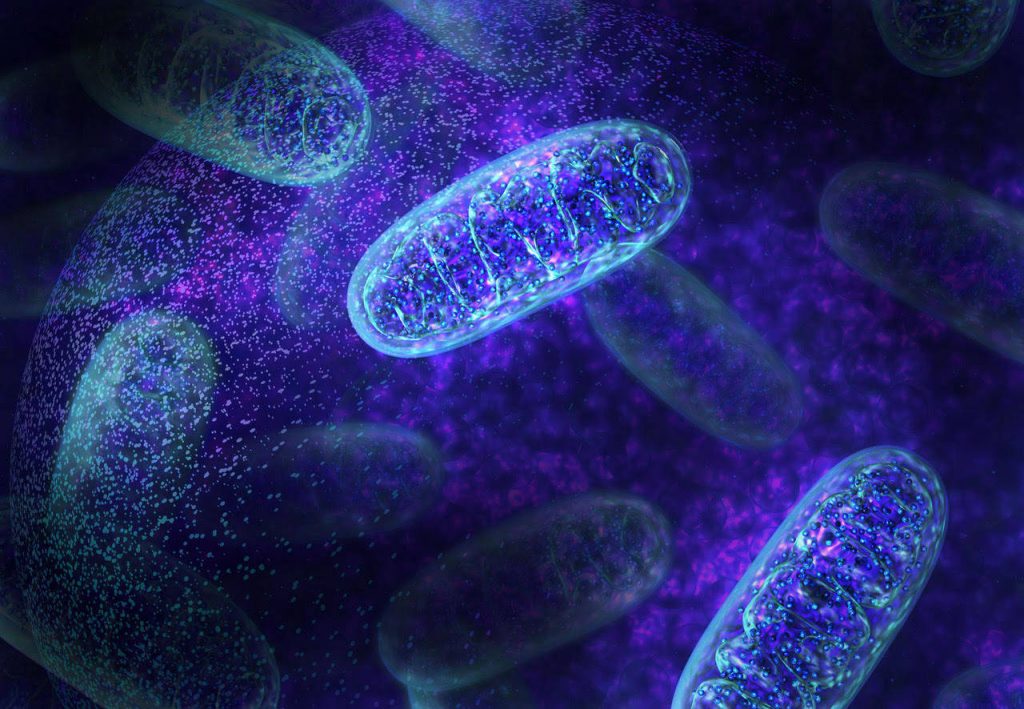
Presný mechanizmus účinku fotobiomodulácie je vo vedeckej komunite stále diskutovaný. Pravdepodobne sa zapája niekoľko mechanizmov v závislosti od typu stimulovanej bunky. Doposiaľ najviac podporovaným mechanizmom je, že cytochróm C, ktorý sa nachádza na vnútornej membráne mitochondrie, pôsobí ako fotoreceptor. Cytochróm C absorbuje svetlo od 500 nm do 1100 nm vďaka špecifickým vlastnostiam tejto veľkej molekuly. Akonáhle je svetlo absorbované, cytochróm C sa excituje, takže sa môže ľahšie viazať s kyslíkom a stane sa cytochróm C oxidázou, zlúčeninou kritickou pre tvorbu ATP. ATP je aktivovaný transportér energie v bunke a uľahčuje mnohé biologické reakcie alebo sekundárne mechanizmy. Tieto bunkové mechanizmy iniciujú redukciu bolesti, redukciu zápalu a hojenie tkaniva.
Bunky a biologické tkanivo reagujú na svetlo v širokom rozsahu vlnových dĺžok, od ultrafialového po takmer infračervené. Voľba správnej vlnovej dĺžky zaručuje, že svetlo bude prenikať cez kožu, tuk a sval do ošetrovaných cieľových buniek. Biologické tkanivo buď odráža, absorbuje, rozptyľuje, alebo prepúšťa svetlo. Primárne chromofory v tkanive, relevantné pre aplikáciu laserovej terapie sú hemoglobín, oxyhemoglobín, voda a melanín.
Ak dôjde k hĺbkovo prenikajúcej fotobiostimulácii, dochádza k úľave od bolesti, zníženiu zápalu a urýchleniu hojenia tkanív. Najlepšie klinické výsledky sa dosiahnu, keď sa do cieľového tkaniva dostane dostatočný počet fotónov. Terapeutická dávka sa meria v Jouloch (J) dodávaných na cm2.
Dokázalo sa, že tkanivá, ktoré sú ischemické v dôsledku zápalu, opuchu a poškodenia vykazujú významne vyššiu odozvu na svetlo lasera ako normálne tkanivo. Biologická reakcia na zaplavenie fotónmi zahŕňa syntézu DNA / RNA, zvýšené hladiny cAMP, syntézu proteínov a kolagénu a proliferáciu buniek. Tieto reakcie vedú k rýchlej normalizácii, regenerácii a hojeniu poškodeného tkaniva – laserové svetlo moduluje bunkový metabolizmus.
Absorpcia energie laserového svetla kožou a podkožným tkanivom sa odhaduje na 50 – 90%, pričom absorpcia sa zvyšuje zároveň so zvyšujúcou sa vlnovou dĺžkou. Dlhšie vlnové dĺžky až do približne 1 000 nm sú výhodné pre hlbšie prenikanie, ktoré iniciuje zmiernenie bolesti a zápalu a urýchlenie hojenia. Prienik svetla do tkaniva je kľúčom k terapeutickým výsledko a dlhšie vlnové dĺžky vedú k hlbšej penetrácii.